Det betyder, at det, vi normalt betragter som 'strukturen' af benzen, ikke er den egentlige struktur.
Selv om der er tre π-bindinger i strukturen af benzen, er der faktisk resonans eller elektrondelokalisering. Dette betyder, at elektronerne ikke er lokaliseret i π-bindinger mellem to specifikke carbonatomer, men fordelt gennem ringen. Dette er en af de vigtigste egenskaber ved et aromatisk system.
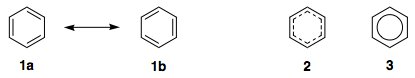
De "lokaliserede" strukturer 1a og 1b ovenfor er resonansformer af benzen: hverken 1a eller 1b er en ægte repræsentation af benzen alene; de er hypotetiske eller "teoretiske" strukturer.
resonanshybrid er et vægtet gennemsnit af resonansformerne 1a og 1b . I dette tilfælde bidrager begge former ligeligt til hybriden. Så hver C-C-binding har en bindingsrækkefølge på (1 + 2) / 2 = 1,5, som vi kan repræsentere ved hjælp af stiplede linjer i 2 (hver stiplede linje repræsenterer en brøkdel af en binding, så en solid og en stiplet linje betyder en bindingsrækkefølge mellem 1 og 2).
Mere symbolsk kan vi også bruge skildringen med en indskrevet cirkel 3 . Dette betyder, at de seks π-elektroner deles mellem alle seks af kulstofatomer.