tl; dr : Der er sandsynligvis ikke en Fe – Fe-binding. Vi bør sandsynligvis stoppe med at tegne et Fe-Fe-bånd. Lærebøger og undervisere bør virkelig stoppe med at undervise studerende om, at der er et Fe-Fe-bånd. Men alt det sagt er der ikke en enkelt tilfredsstillende forklaring på, hvorfor der ikke er en ...
På trods af mange undersøgelser (og på trods af $ \ ce {[Fe2 (CO) 9]} $ er et af de tidligste eksempler på et molekyle med symmetrisk brodannende carbonyler), karakteren af binding i $ \ ce {[Fe2 (CO) 9]} $ er stadig lidt svært at få et klart billede af.
Mens de fleste akademikere på forskningsniveau nu accepterer, at der ikke er nogen signifikant bindingsinteraktion mellem de to metalcentre gentages dette ikke på bachelorniveau, hvor Fe-Fe-bindingsmodellen stadig undervises.
De fleste lærebøger undgår enten problemet helt (giver aldrig en struktur) eller viser Fe-Fe-binding (med en fodnote om, at det måske ikke er korrekt), og selv dem, der anerkender manglen på metal-metalbinding (Elschenbroich er et godt eksempel), diskuterer ikke rigtig, hvordan dette fungerer i praksis, eller hvordan man ville gå omkring elektron optælling (en kilde til mange et grimt selvstudieproblem).
Historisk sammenhæng
Det enkle svar er, at der aldrig rigtig var nogen stærke beviser for tilstedeværelsen af Fe-Fe-båndet. Som det ofte er tilfældet, blev det adopteret af flere (velkendte) kemikere på det tidspunkt, og efterfølgende publikationer (og især lærebøger) udbredte ideen, hovedsagelig på grund af dens bekvemmelighed med hensyn til elektronoptælling.
De tidligste data, der virkelig kiggede på karakteren af Fe – Fe-båndet i $ \ ce {[Fe2 (CO) 9]} $ kan tilskrives en krystalstruktur målt ved Powell (2,46 Å) [1] (senere korrigeret med bomuld (2,53 Å)). [2]
Selvom disse værdier ikke nødvendigvis beviser eksistensen af en Fe – Fe-binding (du kan ikke se en binding med røntgen, kun atomer, hvorfra du kan udlede binding), var dets tilstedeværelse nødvendig for at opfylde 18-elektronreglen, og de opnåede værdier var i overensstemmelse med andre kendte M-M-bindingslængder.
Problemet med ovenstående argument (så praktisk som det er) er, at det er umuligt at fortælle, om 2.53 Å repræsenterer en sand bindingsinteraktion, eller om det simpelthen er en konsekvens af den brodannende Fe – C (O) –Fe-bindinger, der trækker metaller tæt på hinanden. Selve jernet er relativt kontraheret, så i modsætning til i nogle andre broforbundne systemer er det steriske problem med at bringe de to metaller sammen relativt minimalt.
Begyndelsen på forandring
Selvom Fe-Fe-båndet blev vedtaget temmelig vidt, var ikke alle enige.
Roald Hoffmann (af Woodward – Hoffmann-berømmelse) offentliggjorde flere artikler, der syntes at modsige tilstedeværelsen af en Fe-Fe binding, hvilket viser, at interaktionen faktisk var "antikondenserende og frastødende". orbitale diagrammer ved hjælp af molekylær symmetri og isolobale / elektroniske fragmenter (fra velopførte molekyler) for at samle den sandsynlige binding i $ \ ce {[Fe2 (CO) 9]} $ . Til dato er hans fund stort set stadig gyldige (skønt nøjagtige energier nu er beregnet med langt mere nøjagtighed).
Kvantitative beregningsstudier [#]
Moderne beregningsundersøgelser er enige om, at Fe-Fe-interaktionen generelt er netto anti-binding (selvom der er fundet nogle bindingsinteraktioner) uden ægte kovalent Fe-Fe-binding, da blev oprindeligt foreslået.
I Liddles Molecular Metal-Metal Bonds giver McGrady et kvalitativt molekylært orbitaldiagram for komplekset. Orbitalerne σ og σ * såvel som δ π og δ π * orbitalerne (klemt mellem det tidligere par) er fuldt optaget og giver ingen nettobindende karakter. Imidlertid fører populationen af Fe-Fe-antistofbindende π δ * orbitaler til en formel bindingsrækkefølge på –2. [4]
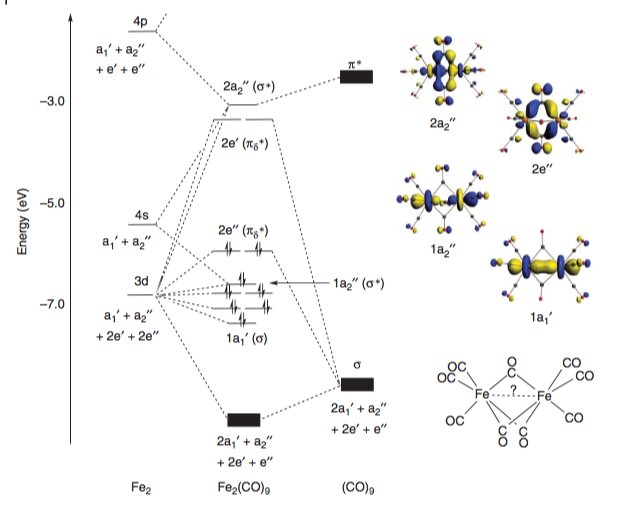 Dette diagram korrelerer godt med resultaterne i en af de tidligste beregningsundersøgelser på dette system, der sammenligner forskellige metoder (DFT, MP2, SCF) af Reinhold. [5]
Dette diagram korrelerer godt med resultaterne i en af de tidligste beregningsundersøgelser på dette system, der sammenligner forskellige metoder (DFT, MP2, SCF) af Reinhold. [5]
I undersøgelsen beregnes forskellige egenskaber for molekylerne (M – M bindingslængde, M – C bindingslængder, bindingsvinkler osv.), og disse data sammenlignes med kendte data fra krystalstrukturer / andet eksperimentelt arbejde. De bestemmer, at kun DFT giver nøjagtige resultater (rejser tvivl om tidligere beregningsarbejde ved hjælp af mindre stringente metoder). [##]
Det konstruerede molekylære orbitale diagram (i overensstemmelse med en fra Ref [4] ovenfor) viser afgørende, at der observeres en negativ overlapning af Fe-Fe orbitaler, hvilket antyder en direkte frastødning. For at citere direkte fra papiret:
i jernsystemerne med mere kontraherede metalorbitaler er den direkte metal-metal-frastødning relativt svag, mens metalbro-bindingerne er tilstrækkelig stærke
Andre beregningsundersøgelser har set at beregne kompleksets egenskaber, såsom vibrationsfrekvenser af enhver foreslået Fe-Fe-binding eller NMR-afskærmninger, der ville være til stede på liganderne med og uden tilstedeværelsen af Fe –Fe bond. Dette arbejde henvises til i Comprehensive Organometallic Synthesis II (bind 6), men synes ikke at have ført til meget nyttige resultater.
Konklusion
Medtagelsesmeddelelsen fra dette er, at der virkelig ikke er sandsynlighed for, at der er en Fe-Fe-bånd på den måde, som det ofte læres at studerende, og bestemt ikke med henblik på elektrontælling.
A god mulig forklaring gives af McGrady, [4] , som giver en forklaring på, hvorfor 18-elektronreglen ikke er vigtig i dette tilfælde (og på et niveau, som en studerende kunne forstå):
Der er faktisk mange paralleller mellem 34-elektron $ \ ce {[Fe2 (CO) 9]} $ og kvadrat- plan 16-elektronarter, ikke mindst begge tendensers reaktion med nukleofiler. Opdelingen af 18-elektronreglen i kvadrat-plane komplekser opstår, fordi den ledige p z orbital ikke finder en passende symmetri match blandt de lineære kombinationer af ligandbaserede orbitaler og anvendes således ikke, hverken til at danne en binding eller til at rumme metalbaserede ensomme elektronpar. [...]
I $ \ ce {[Fe2 (CO) 9]} $ er der to ledige $ \ mathrm {a_2 ''} $ -symmetriske metalbaserede kombinationer (primært lineære kombinationer af 4'er og 4p z ) men kun en optaget ligandbaseret kombination af den samme symmetri. Således forbliver en af de to metalbaserede orbitaler "ubrugte" i samme forstand som p z orbitalen forbliver ubrugt i kvadrat-plane arter. Denne enkle symmetri-baserede analyse antyder, at der ikke er behov for at påberåbe sig en Fe-Fe-binding i $ \ ce {[Fe2 (CO) 9]} $ simpelthen fordi metalcentre overholder ikke 18-elektronreglen.
Referencer & Notes
[1] : Powell, HM; Ewens, R.V.G J. Chem. Soc 1939 , 286
[2]: Cotton, F.A .; Troup, J.M. J. Chem. Soc. Dalton Trans. 1974 , 800
[3]: Lauher, J.W .; Elian, M .; Summerville, R.H .; Hoffman, R. J. Er. Chem. Soc. , 1976 , 98 , 3219
[#]: Fuld offentliggørelse, jeg har læse de fleste papirer, der følger på et tidspunkt, mens du prøver at besvare dette tidligere, men (stor men) Jeg er ikke en beregningskemiker. Jeg håber, at en anden muligvis kan kaste lys over, hvor gyldige disse beregningsresultater faktisk er.
[4]: McGrady, J.E. i Molecular Metal – Metal Bonds ; Liddle, S., red .; Wiley-VCH: Weinheim, 2015
[5]: Hunstock, E .; Mealli, C .; Jose-Calhorda, M .; Reinhold, J. Inorg. Chem. 1999 , 38 , 5053. Bemærk, at dette ikke er en komplet geometrioptimering, de starter med nogle kendte parametre . New J. Chem. 1994 , 18 , 465 er et papir, der angiveligt forsøger fuldstændig optimering fra bunden, men jeg kan ikke finde det nogen steder lige nu for at få adgang til det
[##]: Selv nu er der mange problemer med nøjagtigt beregning af organometalliske kompleksers egenskaber ... det tager en enorm enorm mængde beregningstid på grund af behovet for basissæt langt udvidet sammenlignet med dem, der er udviklet til enkle organiske systemer